生物制品中宿主细胞DNA残留量和残留片段大小质控解决方案
许多生物制品如疫苗、基因治疗产品、重组抗体药/蛋白药等均需用到动物细胞、细菌或酵母作为宿主细胞进行生产。虽然经过严格的纯化工艺,但成品中仍可能有宿主细胞DNA的残留,而这些残留的DNA可能具有潜在的致瘤性和/或传染性风险,因此,需严格的控制生物制品中宿主细胞DNA的残留。
我国药典(2020年版)三部中明确的列出了各类生物制品中外源DNA残留量的要求,如冻干人用狂犬病疫苗(Vero细胞)采用荧光定量PCR法进行原液检定,Vero细胞DNA残留应不高于3ng/剂;重组乙型肝炎疫苗(CHO细胞)中CHO细胞DNA残留量应不高于10pg/剂。我国国家药品监督管理局药品审评中心发布的《体内基因治疗产品药学研究与评价技术指导原则(试行)》中提到 “生产若使用了肿瘤细胞系(如 Hela细胞)、致瘤细胞系,或携带有致瘤基因、病毒来源序列的细胞(如 HEK 293T细胞),在确保无完整活细胞残留的同时,需对DNA的残留量和残留片段大小进行控制,合理拟定标准限度。如有可能,建议尽量将残留DNA控制在10ng/剂以内,DNA残留片段的大小控制在 200bp以下。”
美国FDA在《Characterization and Qualification of Cell Substrates and Other Biological Materials Used in the Production of Viral Vaccines for Infectious Disease Indications》的行业指南中要求对残留的DNA进行检测。按照WHO的建议,对于非肠道接种的疫苗,应将非致瘤性连续细胞如低传代Vero细胞的残留DNA限制在10 ng/剂以下。建议口服疫苗将残留DNA限制在100µg/剂量以下。降低细胞基质DNA的生物活性可以减少致瘤性和感染性风险,这可以通过减少残留DNA的量或降低DNA片段的大小至功能基因大小(基于目前的证据,大约200bp)以下来实现。美国FDA在《Chemistry, Manufacturing, and Control (CMC) Information for Human Gene Therapy Investigational New Drug Applications (INDs) 》的行业指南中也建议将非致瘤性连续细胞的残留DNA量限制在10 ng/剂以下,DNA大小限制在约200bp以下。
对宿主细胞DNA残留量的检测,我国药典(2020年版)三部通则推荐了三种方法,包括DNA探针杂交法、荧光染色法及定量PCR法。美国药典(2016年版)推荐了杂交法、DNA结合蛋白法和定量PCR法。其中定量PCR法以特异性好、灵敏度高、准确性好、易于高通量等优势被广泛采用。而对宿主细胞DNA残留片段大小的检测目前还没有特定推荐的方法。
基因有限公司为您提供完整的宿主细胞DNA残留质控方案。Agilent AriaMx荧光定量PCR仪可以让您实现准确的宿主细胞DNA残留量检测,Agilent 5200片段分析仪可以让您实现自动化、高通量、高灵敏度、可靠的宿主细胞DNA残留片段大小质控。
宿主细胞DNA残留量检测
Agilent AriaMx
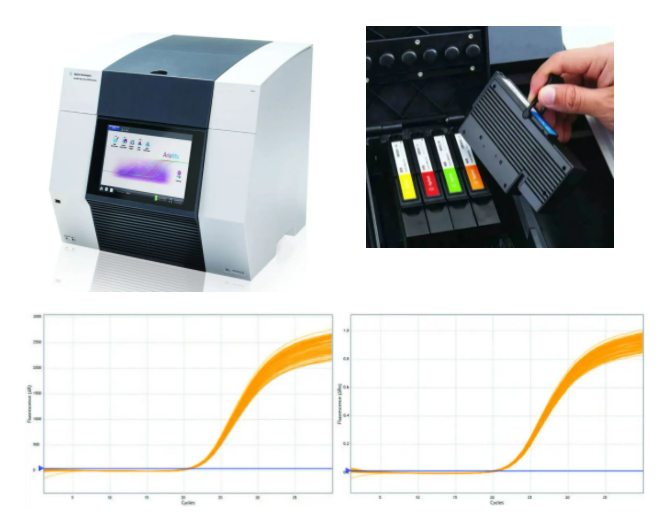
AriaMx是Agilent公司秉承Mx3000P/3005P优异性能的基础上推出的一款更灵活、可靠和快速的荧光定量PCR仪。
在AriaMx上不采用和采用ROX矫正,Cq都有非常好的一致性
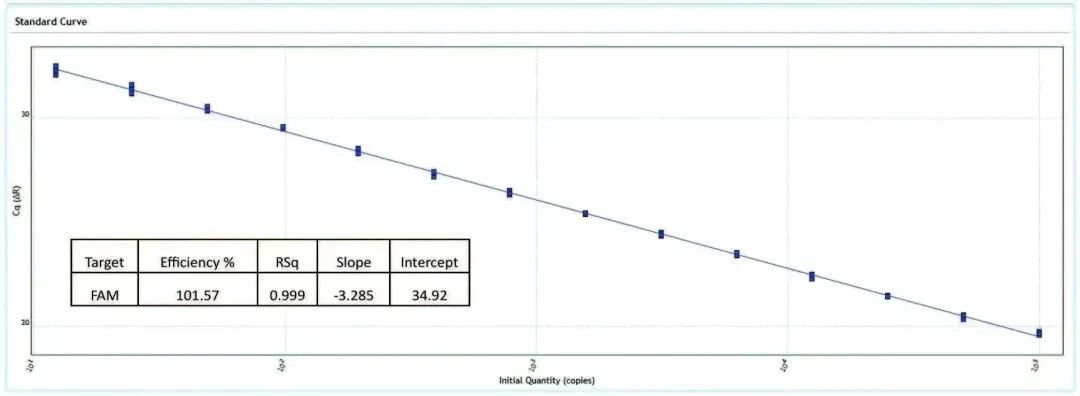
AriaMx能在宽的拷贝数范围内以95%的置信区间识别2倍差异
灵活:卡夹式光路设计,可灵活选择1-6个卡夹即1-6个荧光通道。可在实验室轻松实现后续升级。
快速:8孔并行检测,完成96孔板6个通道的一次信号采集时间小于3秒。
准确:优异的热循环性能可将温控准确性控制在±0.2°C以内。经过成千上万次实验验证,Cq St Dev <0.20。能够在宽的拷贝数范围内以95%的置信区间识别2倍差异。
AriaMx荧光定量PCR仪正在进行免费试用活动,欲申请试用或了解产品详情,请扫码联系我们的技术人员。
宿主细胞DNA残留片段大小质控
Agilent 5200片段分析仪
Agilent 5200片段分析仪是一款基于多道平行毛细管的自动化电泳系统,为您提供自动化、快速、高灵敏度、可靠的宿主细胞DNA残留片段大小质控。
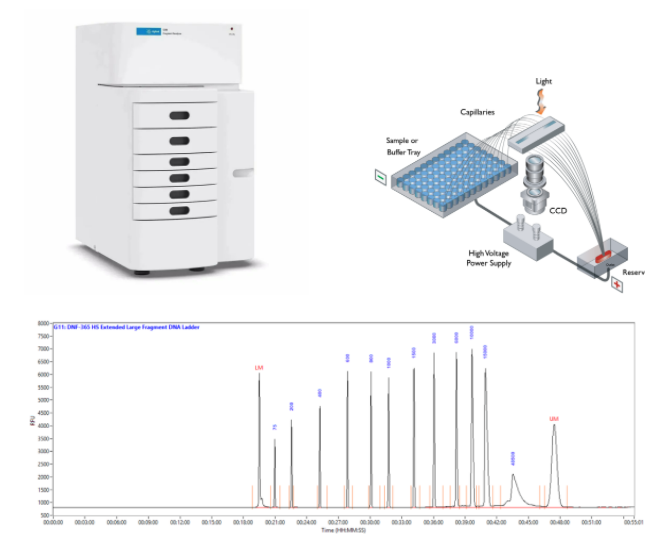
自动化:全自动完成灌胶、上样、跑胶、清洗等步骤。
快速:可在15min内平行完成12个样品的分离。
高灵敏度:可检测低至5pg/μL的DNA片段。
高分辨率:可轻松实现仅3 bp差异的DNA片段(300bp以内)的分离和分子量测定。
座机
021-58390070
发送您的留言
微信扫码咨询

